面对种类繁多、习性各异的病原微生物,植物进化出了第一道免疫防线PTI(PAMP-triggered immunity),而位于细胞表面的免疫受体复合体的组装和活化是启动免疫反应的关键步骤。其中最为典型的是拟南芥细菌鞭毛蛋白受体FLS2复合体的组装。当其识别配体后,FLS2与共受体BAK1结合,继而磷酸化胞质激酶BIK1来激活下游免疫信号。迄今为止,参与调控FLS2和BAK1组装的分子逐渐被挖掘,然而介导FLS2和BIK1复合体形成的机制尚不清楚。
在拟南芥中,Myosin XI是一类以微丝骨架为轨道的分子马达,为胞质环流,细胞器和囊泡运输等胞内活动提供动力。之前有研究表明BIK1的互作蛋白质谱结果中包含Myosin XIK,该项研究首先验证了Myosin XIK能够与FLS2和BIK1分别相互作用,并且是FLS2受体复合体的成员之一(如图1所示)。
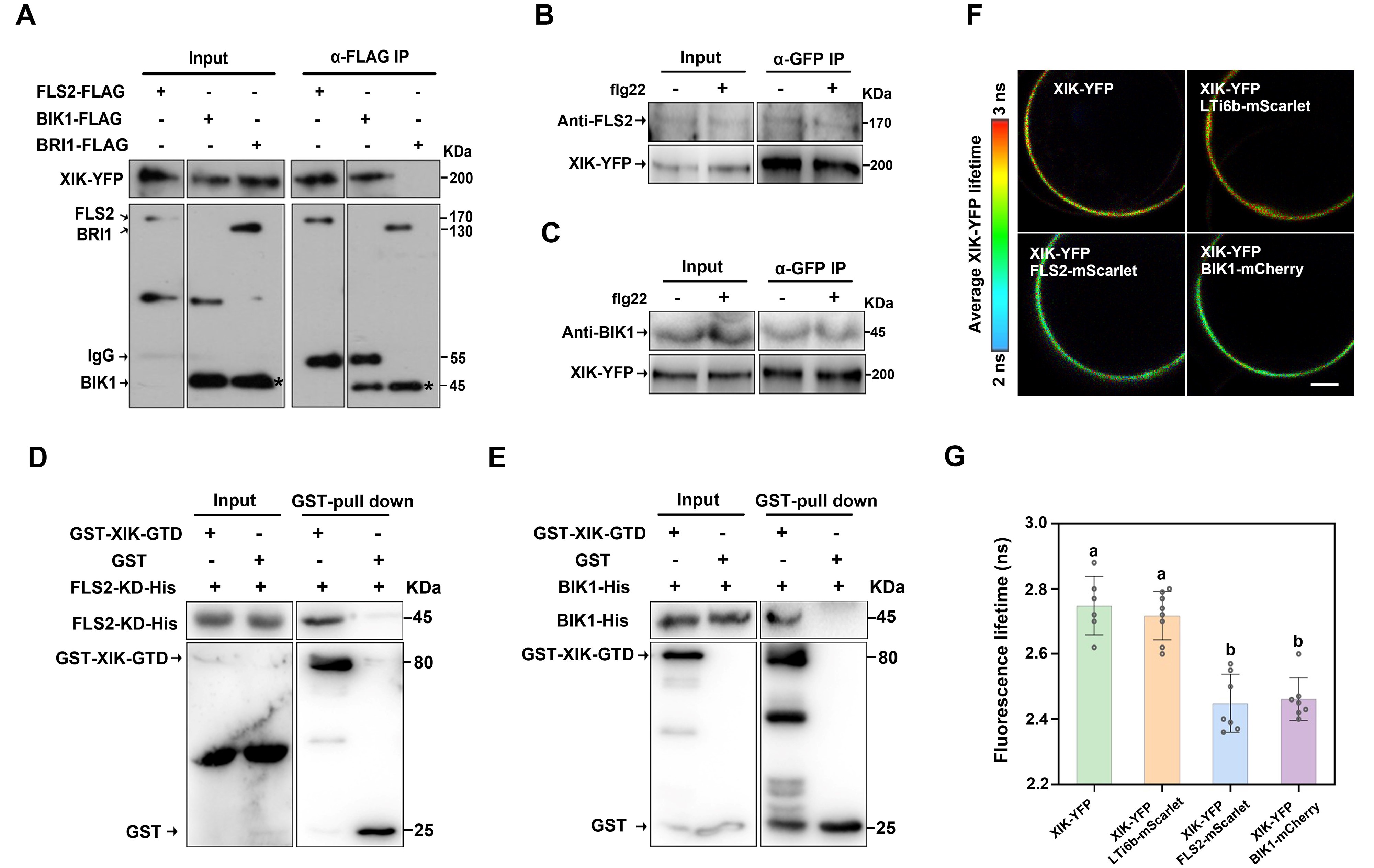
图1 Myosin XIK与FLS2-BIK1复合体相互作用
通过生化手段,研究者发现Myosin XIK调控FLS2和BIK1的组装,当缺失Myosin XIK时,FLS2和BIK1的复合物不能稳定形成,由此导致BIK1的磷酸化及其下游的免疫信号均不能激活(如图2所示)。
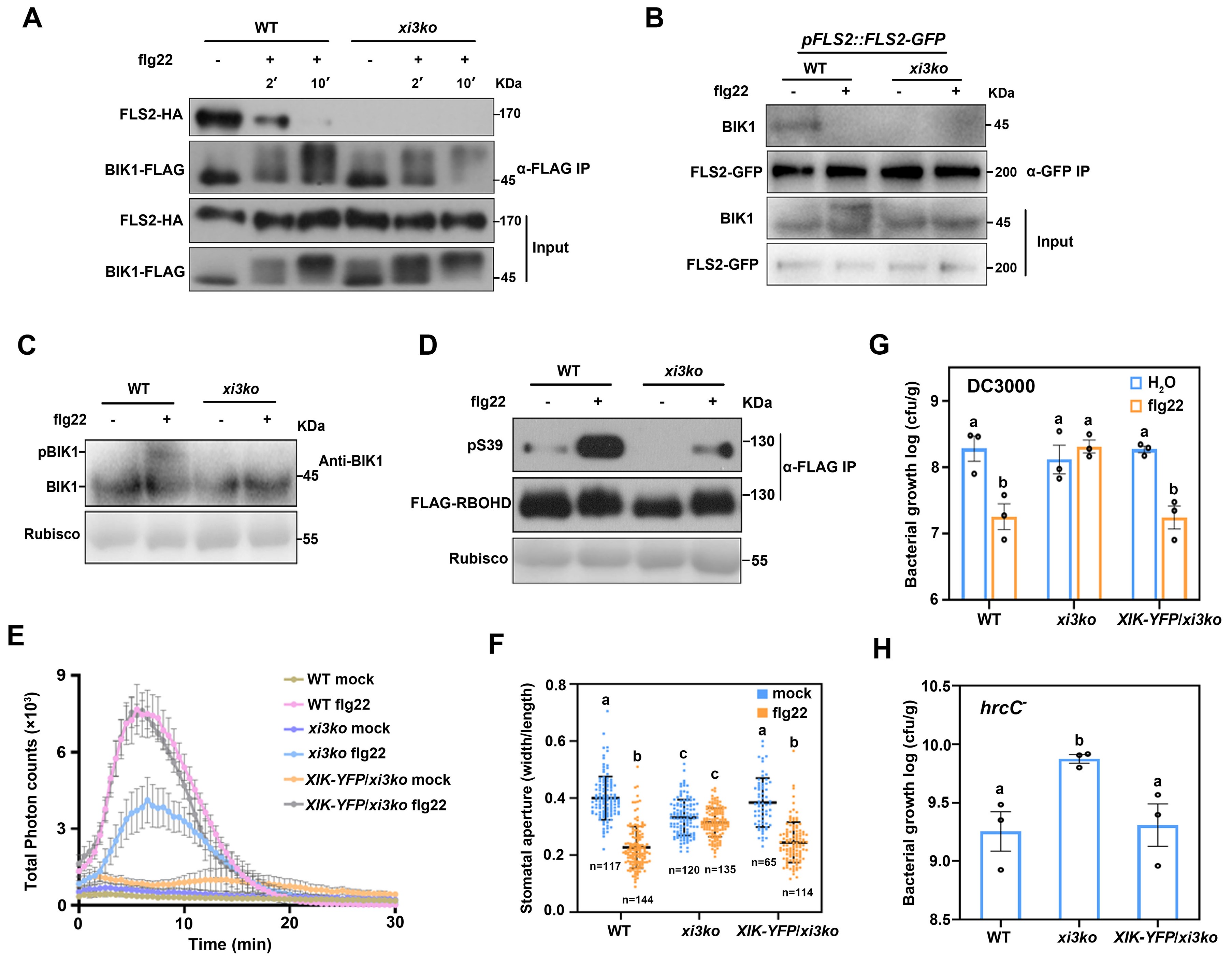
图2 Myosin XIK调控FLS2-BIK1的组装以及下游免疫反应
通过高时空分辨率单分子成像等手段,研究人员对FLS2和BIK1在质膜上的动态进行了分析。结果显示,BIK1在质膜上的运动活跃,而FLS2的运动则相对受限。Myosin XI主要限制BIK1在质膜上的扩散,而对FLS2的动态影响较小(如图3所示)。
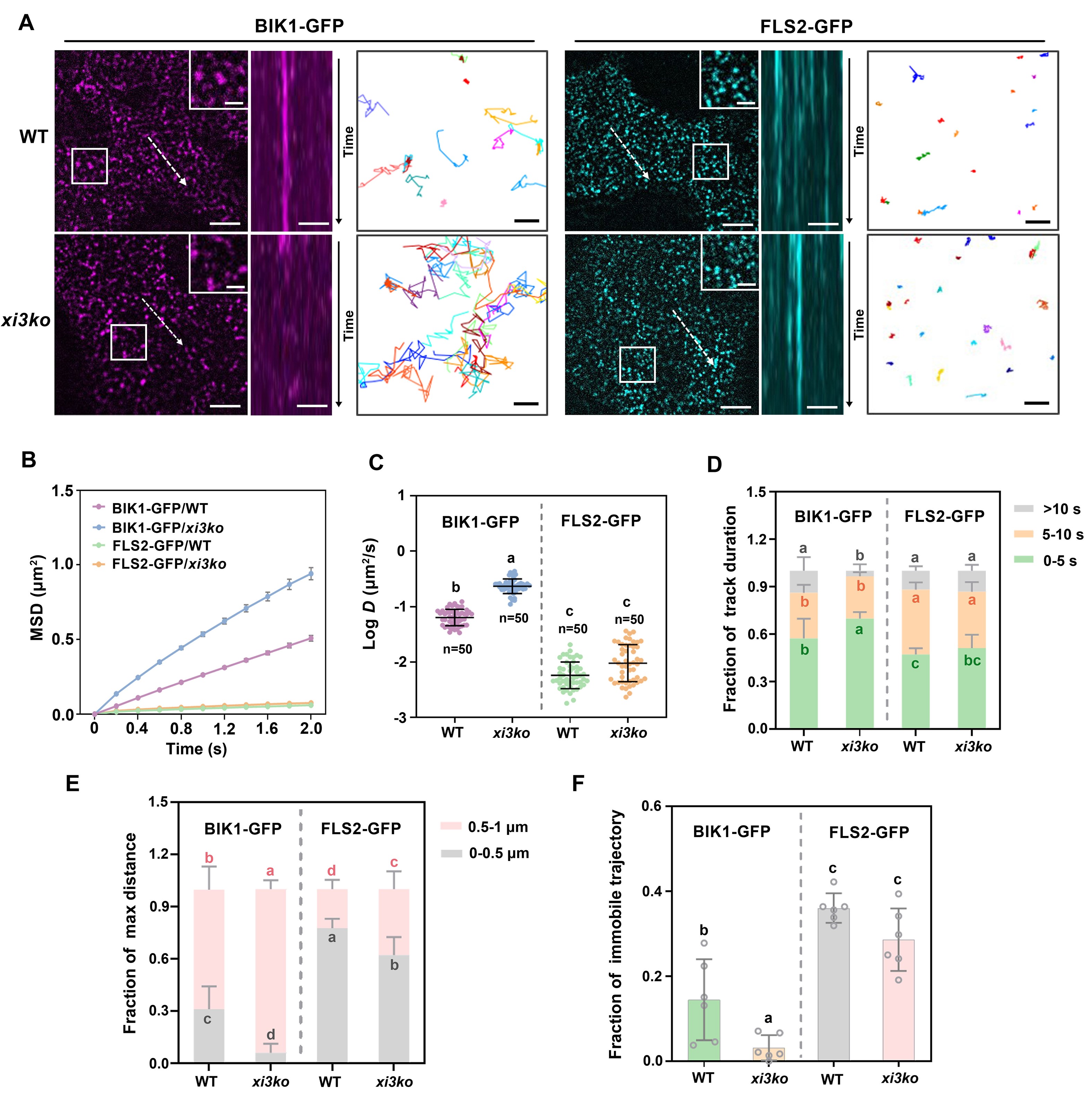
图3 Myosin XI调控BIK1的质膜动态
与免疫共沉淀等生化结果不同的是,细胞学的证据表明FLS2和BIK1在质膜上并不表现为组成型的结合,而以动态互作的形式为主,且运动受限的BIK1更易与FLS2互作(如图4所示)。
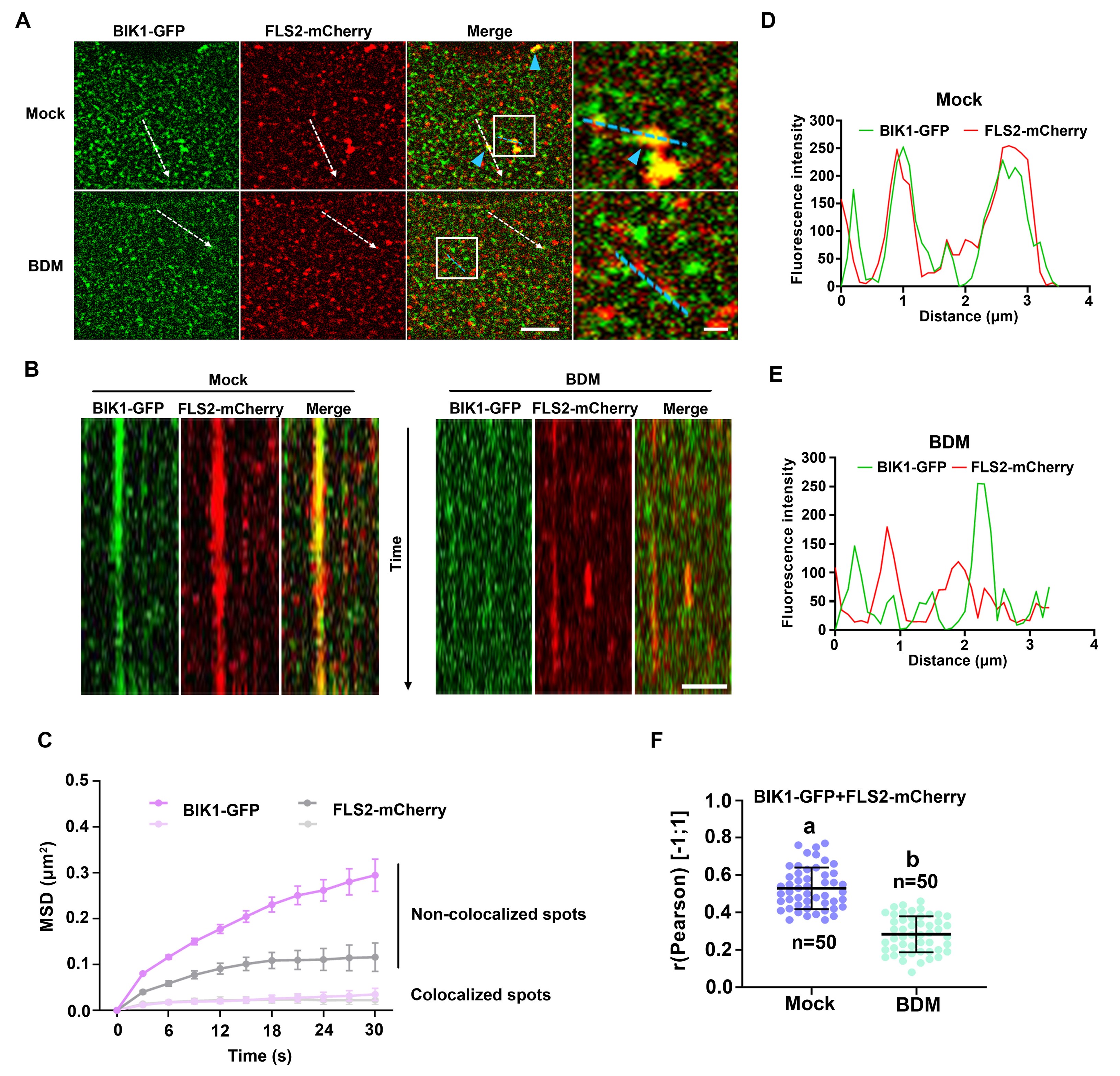
图4 细胞学上实时监测FLS2和BIK1共定位的动态行为
研究者还发现Myosin XIK、FLS2和BIK1三者共同定位在同一种膜微域内。Myosin XIK负责将BIK1招募至FLS2所在的膜微域,并将其稳定于此,从而确保它们能形成稳定的复合物(如图5所示)。
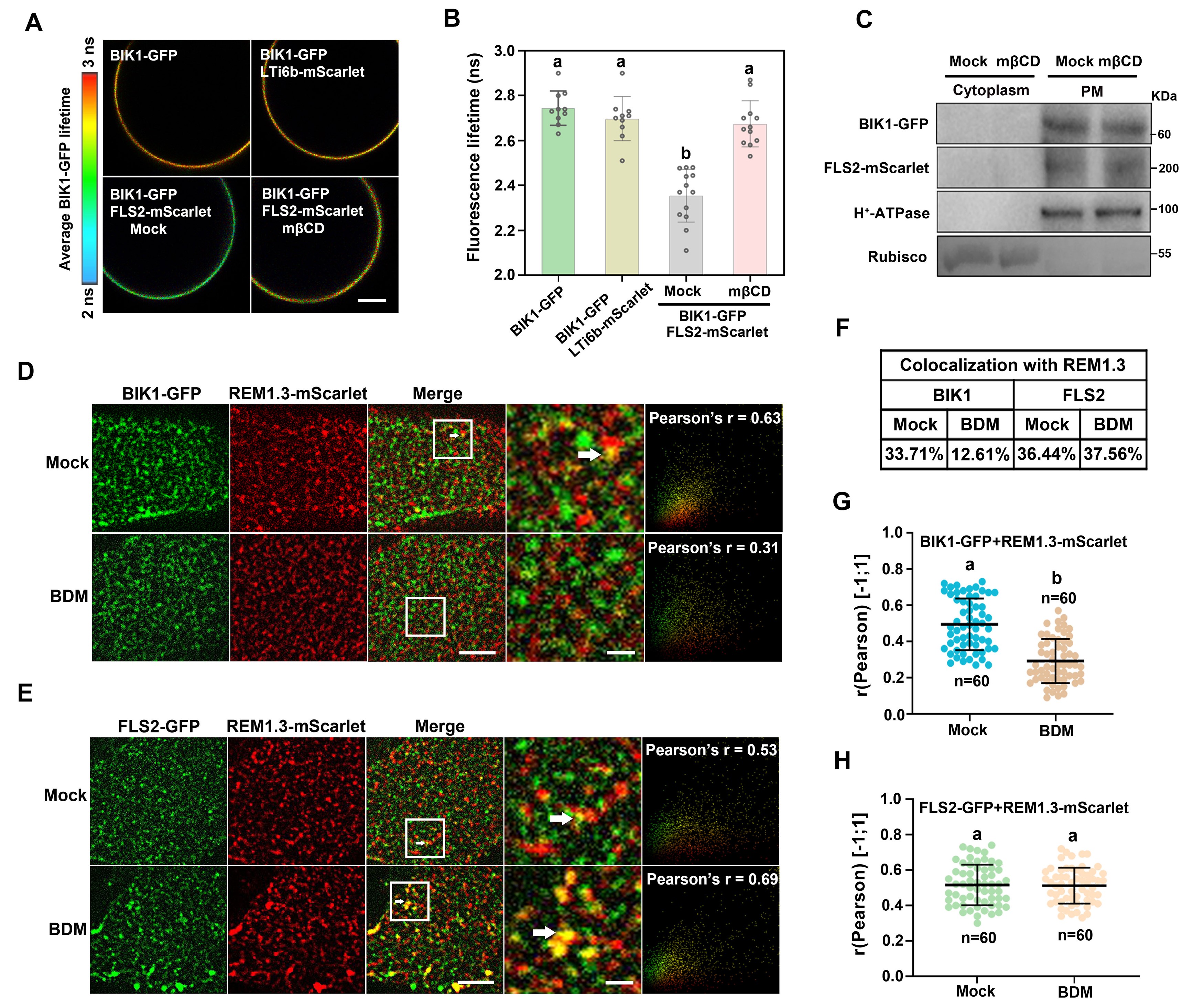
图5 Myosin XI招募BIK1至FLS2所在的膜微域
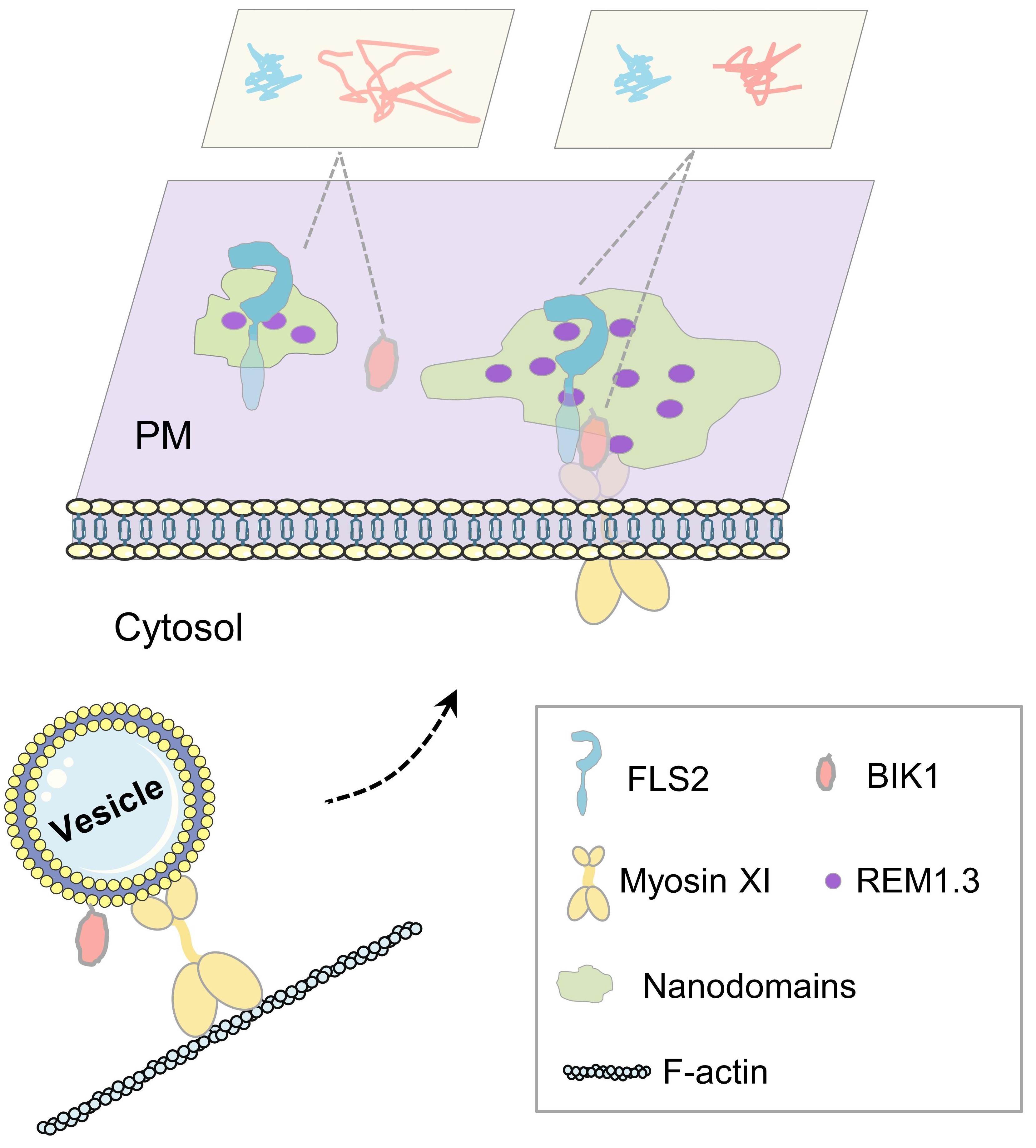
图6 Myosin XI调控FLS2-BIK1组装的工作模型
该项工作为细胞表面免疫受体复合物的组装机制提供了细胞生物学证据。此外,该研究还揭示了Myosin XI的新功能,即除了作为分子马达以外,它还可以扮演分子支架的角色稳定蛋白复合体的组装。由于肌球蛋白家族在植物中规模庞大,因此,除了FLS2受体复合体之外,肌球蛋白各个成员是否还调节其他受体复合体的组装,这一问题还需要通过进一步研究来解答。
上述研究成果以“Myosin XI-mediated BIK1 recruitment to nanodomains facilitates FLS2–BIK1 complex formation during innate immunity in Arabidopsis”为题,于2024年6月14日在国际学术期刊PNAS(IF=11.1)上发表。北京师范大学生命科学学院已毕业博士生王冰肖为本文第一作者,生命科学学院教授李杰婕为论文的通讯作者。中国科学院遗传与发育生物学研究所研究员周俭民和中国农业大学副教授周朝阳也参与了这项研究,北京师范大学抗性基因资源与分子发育北京市重点实验室为第一完成单位。该工作得到了国家自然科学基金重大研究计划(92054101)和优秀青年科学基金项目(32122013)的资助。

王冰肖博士(第一作者,左一)与导师李杰婕教授(通讯作者,右一)