1月12日,北师大生命科学学院王友军教授课题组与美国德州农工大学Huang Yun和Zhou Yubin教授实验室合作,在窦非教授和孙林副教授团队的帮助下,共同在Nature Communications杂志上发表题为“Engineering of a bona fide light-operated calcium channel”的文章(IF: 12.121)。王友军教授课题组2019级博士生王刘清与美国德州农工大学博士后何涟为该研究的共同第一作者。

由质膜上的Orai蛋白与内质网膜上的STIM蛋白共同介导的钙释放激活的钙(Ca2+ release-activated Ca2+ , CRAC)信号参与调控基因表达、生长增殖以及衰老死亡等众多生物学过程,是动物细胞中普遍存在的一种重要钙信号产生机制。CRAC功能失调与许多疾病,特别是免疫及包括阿尔兹海默症在内的神经退行性疾病等,密切相关。因而开发能操纵CRAC信号的工具具有非常重要的科学和医学意义。光遗传学技术具有时空特异性高、可逆性强及毒副作用小等优点,是操纵钙信号的新兴方式。但目前的光遗传学钙工具存在着钙选择性低、非特异性靶点多、易产生副反应等缺点,在实际应用中的局限较大。为此,研究团队将LOV2光控元件插入突变的Orai1蛋白的loop区,首次获得了一种单元件的光控钙通道:LOCa3。该工具可被蓝光可逆激活,介导钙内流(图1A-1B)。LOCa3是光遗传领域首个四次跨膜的光激活通道,它还保留了Orai1通道的高度钙选择性。 团队利用LOCa3在细胞及在体水平上实现了对钙信号的光开关。
团队进一步在细胞及动物模型水平上展示了光开关的LOCa3对CRAC相关疾病的治疗作用。细胞水平上,LOCa3能够有效抑制癌化造血干细胞的异常自我更新,精准调控靶基因表达以及细胞自噬。在体水平上,表达LOCa3的阿尔兹海默症(AD)果蝇,被蓝光照射后其减弱的攀爬能力等AD表型得到了显著增强(图1C-1D)。以上结果均体现了LOCa3在生物工程及生物医学中的潜在应用价值。
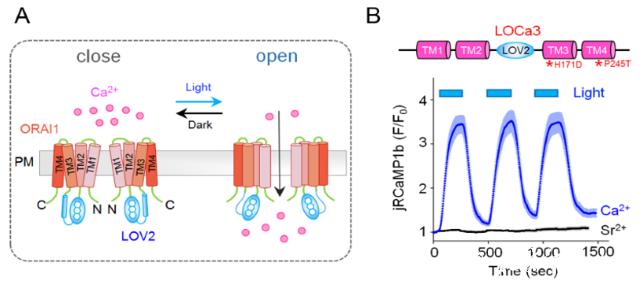
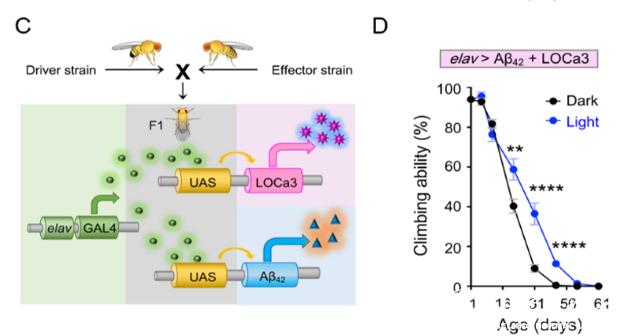
LOCa3的光开关反应及在体应用。(A)设计示意图,(B)可逆光控钙信号,(C)AD-LOCa3果蝇设计示意图,(D)蓝光照射对AD果蝇攀爬能力的影响。
本研究受到国家自然基金委面上及重大研究计划项目(91954205,31671492),以及科技部重大研发计划课题(2019YFA0802104)的资助。
原文链接:https://www.nature.com/articles/s41467-020-20425-4